ピリチオバックナトリウム塩の発見経緯
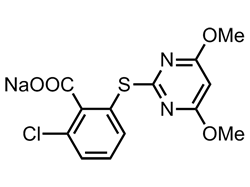
ピリミジニルカルボシキ系(PC系)化合物は、安息香酸のオルソ位にピリミジニルオキシ基又はチオ基が結合した構造を基本骨格として、様々な置換基の導入が行われた。
その中で、2-クロロ-6-(4,6-ジメトキシピリミジニルオキシ)安息香酸メチルが約500g/haの薬量で、土壌処理において棉に対し選択性を示した。
当化合物は、PC系化合物の中から棉用除草剤を創製するプロジェクトのパイロットとしての役割を果たしたが、活性は本系統化合物としては低いものであった。その原因は、メチルエステル基が両オルソ位に置換基があるため安定で、活性本体のカルボン酸になりにくいためと考えられた。実際、加水分解を行うとメチルエステルよりも先にピリミジニルオキシ基の方が分解し、カルボン酸を合成することはできなかった。活性本体のカルボン酸を合成しようと、加水分解条件の検討や、求核反応試薬を水以外のシアン、ハロゲンやチオールに変えた検討を行ったが、なんらも穏和な条件では全く反応せず、反応条件を厳しくするとジメトキシピリミジニルオキシ基が反応してしまい、目的物を得ることができなかった。
そこで求核反応ではないエステルの脱保護法はないかと合成化学の本をひっくり返して見てみると、ベンジルエステル加水素分解法が解説してあった。
その反応機構の解説を読んで、これは使えると思いカルボン酸体の合成に応用した。
今から思えば合成屋としては恥ずかしい話ではあるが、この加水素分解法に行き着くまでに8ケ月も要してしまった。これも今にしては幸いなことだが、しばしば副反応として観測される脱クロル化が起こることもなく、この方法により合成することができた。
余談になるが、この加水素分解法がPC系化合物の中で高活性体である6-位置換体の一般的合成法になり、多くの誘導体合成を可能にしたのであった。
当カルボン酸体は予想通りメチルエステル体よりもはるかに除草活性が強く、10g a.i./ha前後の薬量でトリフルラリン+コトランと同等以上のスペクトラム・活性を示した。
しかし選択性は未だ不十分で、高選択性を目標とした最適化が引き続き行われた。最適化は製造コスト面での有利さを考慮して、カルボン酸エステルの変換、2-位クロロ基の変換、酸素原子の変換の順に行われた。
酸素原子を硫黄原子に変換すると活性が低下することが予想されていたことと6-位置換チオサリチル酸の良い工業的製造法がなかったことから、酸素原子の変換は優先順位が最も低いものであった。カルボン酸エステルの変換、2-位クロル基の変換を中心に約1年間300化合物をスクリーニングに提供したが、活性の強弱や若干のスペクトラムの変化は見られたものの、選択性の面で本質的な進歩はなかった。
しかし、系統化合物の見直しを進めるうちに安息香酸ベンゼン環が無置換のものについて、ベンゼン―ピリミジン間のブリッジ原子を酸素原子から硫黄原子に変換した先例があった。この化合物の除草活性は約1/10に低下したが、ALS阻害活性は低下していなかったため、ブリッジ原子を酸素から硫黄に変換しても殺草ポテンシャルは維持されるものと考えた。
背水の陣の心境で2-クロロ-6-(4,6-ジメトキシピリミジニルオキシ)カルボン酸のブリッジ原子を硫黄に変換し2-クロロ-6-(4,6-ジメトキシピリミジニルチオ)カルボン酸(ピリチオバック)、その除草活性を調べることにしたのである。
ピリチオバックはオキシ体に比べ、禾本科雑草に対しての活性は予想通り1/8~1/16低下したが、広葉雑草に対する活性は1/2~1/4程度低下しただけであった。
一方、ピリチオバックのALS阻害活性はI50値で32nMであり、オキシ体のI50値24nMとほぼ同等であり、これも予想通りであった。全く予想外であったのは棉に対する薬害が1/256~1/512に低下したことであった。
その後、ピリチオバックは50~100g a.i./haの薬量でイチビ、アサガオ等の難防除大型種子広葉雑草を含めた種々の広葉雑草に卓効を示す高選択性除草剤であることが明らかにされ、棉用新規除草剤として開発が開始された。さらに工業的製造法に適したピリチオバックNa 塩として開発が継続され、6-クロロチオサリチル酸の工業的製造法も確立されて今日に至っている。
ピリチオバックの成功は、課題を解決するためには最後まで諦めず、あらゆる可能性を追求し、それを実験事実としてきちんと評価するという当たり前のことが如何に大事であるかを示しているように思われる。
